Densidade relativa é a relação entre a densidade da substância em causa e a massa volúmica da substância de referência (a água é geralmente tomada como referência). É uma grandeza adimensional, devido ao quociente. Quando se diz que um corpo tem uma densidade de 5, quer dizer que tem uma massa volúmica 5 vezes superior à da água (no caso dos sólidos e líquidos).
quimicawww
quarta-feira, 1 de junho de 2011
Densidade
A densidade (também massa volúmica ou massa volumétrica ou massa específica) de um corpo, define-se como o quociente entre a massa e o volume desse corpo. Desta forma pode-se dizer que a densidade mede o grau de concentração de massa em determinado volume. O símbolo para a densidade é ρ (a letra grega ró) e a unidade SI para a densidade é quilogramas por metro cúbico (kg/m³).
Densidade relativa é a relação entre a densidade da substância em causa e a massa volúmica da substância de referência (a água é geralmente tomada como referência). É uma grandeza adimensional, devido ao quociente. Quando se diz que um corpo tem uma densidade de 5, quer dizer que tem uma massa volúmica 5 vezes superior à da água (no caso dos sólidos e líquidos).
Densidade relativa é a relação entre a densidade da substância em causa e a massa volúmica da substância de referência (a água é geralmente tomada como referência). É uma grandeza adimensional, devido ao quociente. Quando se diz que um corpo tem uma densidade de 5, quer dizer que tem uma massa volúmica 5 vezes superior à da água (no caso dos sólidos e líquidos).
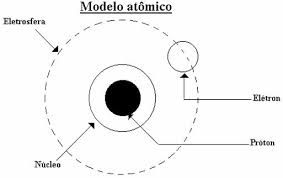
Elétrons
O elétrons ou electrão, geralmente representado como e-, é uma partícula subatômica que circunda o núcleo atômico, identificada em 1897 pelo inglês John Joseph Thomson. Subatómica e de carga negativa, é o responsável pela criação de campos magnéticos e eléctricos.

quinta-feira, 26 de maio de 2011
Número atômico
Número atômico (Z) é um termo usado na física e na química para designar o número de prótons (protões em português europeu) encontrados no núcleo de um átomo. Num átomo com carga neutra, o número de elétrons é idêntico ao número atômico,ou seja o número atómico e a identidade do átomo. O mesmo não acontece nos íons, átomos com falta ou excesso de elétrons nas últimas camadas. A descoberta do número atômico foi associada ao físico britânico Henry Moseley, o qual conseguiu determinar a carga do núcleo atômico, e sabendo a carga do mesmo, é possível determinar a quantidade de prótons em qualquer átomo.
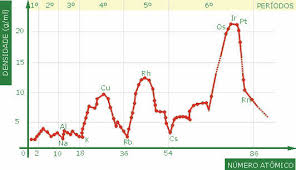
Volume atômico
Volume atômico designa o volume ocupado por um mol átomos de um elemento numa fase condensada (líquida ou sólida). É expresso em cm3/mol. Assim, o volume atômico sempre se refere ao volume ocupado por massa do Avogrado átomos e pode ser calculado relacionando-se a massa desse número de átomos com sua densidade.
Raio atômico
O raio atômico é a distância entre o centro de um átomo e os limites da sua eletrosfera. Ao contrário do que se poderia pensar, o raio atômico não depende apenas do peso do átomo e/ou da quantidade de elétrons presentes na eletrosfera. É também fortemente afetado pela eletronegatividade de cada elemento.
Simplificadamente, o raio atômico é a distância entre o centro do átomo e a sua camada de valência, que é o nível de energia com elétrons mais externo deste átomo. Como consequência do átomo não ser rígido é impossível calcular o seu raio atômico exato. Deste modo, calcula-se o seu raio atômico médio.
Devido a dificuldade em obter-se o raio de átomos isolados determina-se ( através de raio X ) a distância entre os núcleos de dois átomos ligados do mesmo elemento, no estado sólido. O raio atômico será a média da distância calculada.
Simplificadamente, o raio atômico é a distância entre o centro do átomo e a sua camada de valência, que é o nível de energia com elétrons mais externo deste átomo. Como consequência do átomo não ser rígido é impossível calcular o seu raio atômico exato. Deste modo, calcula-se o seu raio atômico médio.
Devido a dificuldade em obter-se o raio de átomos isolados determina-se ( através de raio X ) a distância entre os núcleos de dois átomos ligados do mesmo elemento, no estado sólido. O raio atômico será a média da distância calculada.
Lei periódia de Mendeleev
Dimitri Mendeleev foi um químico russo muito famoso. É considerado pela comunidade científica um dos maiores gênios da química. Mendeleev nasceu em Tobolsk, na Sibéria, em 1834. Doutorou-se na Universidade de São Petersburgo, onde começou a lecionar em 1866. O conceito de periodicidade química deve seu desenvolvimento, em especial, a dois químicos, Lothar Meyer (alemão) e Dimitri Mendeleev (russo).
Trabalhando independentemente, chegaram a um correlacionamento mais detalhado das propriedades dos elementos e suas massas atômicas. Isso proporcionou uma melhor visualização da periodicidade das propriedades dos elementos.
Vários cientistas contribuíram para que se chegasse à classificação periódica dos elementos; porém o trabalho de Mendeleev destacou-se por ser o mais completo e ousado.

quarta-feira, 25 de maio de 2011
Assinar:
Postagens (Atom)